Các nhà nghiên cứu tế bào gốc tại UC San Francisco đã tìm thấy một vai trò quan trọng của một loại protein gọi là BMI1 có thể giúp các nhà khoa học trong định hướng phát triển các mô để thay thế các bộ phận bị hư hỏng trong cơ thể con người.
“Các nhà khoa học đã biết rằng Bmi1 là một bộ phận chuyển đổi điều khiển trung tâm trong các tế bào gốc trưởng thành của nhiều mô, bao gồm não, máu, phổi và tuyến vú”, TS. BS Ophir Klein, chỉ đạo chương trình Sinh học trung mô (CMB) và Hàm Mặt và là chủ tịch của Phòng nghiên cứu các bất thường sọ mặt tại UCSF. “Bmi1 cũng là một gen gây ung thư, trở nên kích hoạt trong tế bào ung thư.”
Nhóm nghiên cứu của Klein đã chỉ ra rằng BMI1 đóng một vai trò trong việc đảm bảo quá trình phát triển mở ra bình thường.
Điểm nổi bật của tất cả các tế bào gốc là chúng chưa trưởng thành, chúng tiếp tục phân chia để bổ sung số lượng gần như vô hạn, và chúng tạo ra tế bào chuyên biệt mới hoạt động trong các mô trong đó chúng cư trú, một quá trình được gọi là sự biệt hóa tế bào.
Theo một hướng, việc chuyển đổi BMI1 cho phép các tế bào gốc bình thường phân chia và đổi mới số lượng của chúng. Theo một hướng khác, chúng vẫn không ngừng tăng sinh tế bào có kiểm soát. Nhưng bây giờ, nhóm nghiên cứu Klein đã chỉ ra rằng BMI1 cũng giữ lại đặc tính này này của các tế bào gốc từ việc sản sinh ra các thế hệ con cháu sau đó trưởng thành thành các dạng tế bào chuyên biệt sai hỏng tại địa điểm sai.
Phát hiện mới cho thấy thao tác BMI1, cùng với các phân tử điều hòa khác, có thể một ngày nào đó sẽ trở thành một trong những bước trong công thức phân tử để tắt và mở sự phát triển của tế bào chuyên biệt để tạo ra phương pháp điều trị mới dựa trên tế bào cho các mô bị mất, thậm chí chấn thương, bệnh tật hoặc lão hóa, Klein nói.
Vai trò kép của BMI1 cũng là một vấn đề hấp dẫn để suy nghĩ trong các thiết lập về bệnh lý, chẳng hạn như ung thư, Klein nói. Các bằng chứng tiến tới cho thấy nhiều bệnh ung thư được điều khiển bởi các biểu hiện bất thường của tế bào gốc trưởng thành hoặc bởi các tế bào có đặc tính giống tế bào gốc có nhu cầu bất thường. Nếu các tế bào ung thư có thể được xử lý để trở thành tế bào chuyên biệt hơn là các tế bào gốc khi chúng phân chia, nó có thể làm chậm sự phát triển của khối u, một số nhà nghiên cứu ung thư tin như vậy. Bất hoạt BMI1 trong các tế bào gốc ung thư có thể là một chiến lược, Klein đề nghị.
Công trình của nhóm nghiên cứu Klein được công bố trên số ra tháng Bảy của tạp chí Nature Cell Biology, và được thực hiện trên các tế bào gốc trưởng thành được tìm thấy trong các răng cửa lớn của những con chuột.
Klein, một giảng viên của Trường Đại học Nha khoa UCSF, cũng như trường Y khoa, nghiên cứu trên răng, ruột và các mô khác để hiểu được cơ chế sinh học và phân tử điều hòa tế bào gốc trong những cơ quan này. Kiến thức thu được trong các nghiên cứu này có thể tiếp tục cung cấp nhiên liệu cho những quan tâm cụ thể của ông trong việc tìm kiếm những cách thức mới để tạo ra các mô thay thế để chữa các bệnh như bệnh Crohn và bất thường sọ mặt – và phát triển răng mới.

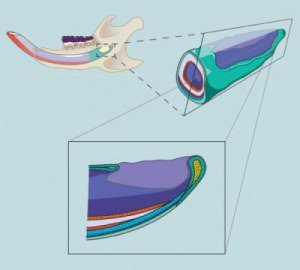
Các nhà nghiên cứu tập trung vào các tế bào gốc (màu vàng) tại các vùng nền phát triển của răng cửa chuột, nằm trong một lớp bề mặt của các tế bào (màu xanh đậm). Các tế bào gốc tách ra khỏi các tế bào tiền thân (màu xanh nhạt), do đó làm tăng nguyên bào tạo men (màu xanh), đó là các tế bào tạo men (màu đỏ). Nguyên bào ngà (màu cam) phát sinh từ một nhóm tế bào gốc khác và trở thành ngà răng (màu trắng). (Ảnh: Jimmy Hu)
Các răng cửa của con chuột, không giống như bất kỳ răng nào của con người, phát triển liên tục, và là một vấn đề hấp dẫn cho nghiên cứu tế bào gốc, theo quan điểm của Klein. “Có một số lượng lớn quần thể tế bào gốc, và cách thức các tế bào con của các tế bào gốc được sản xuất rất dễ dàng để theo dõi – như thể chúng đang ở trên một băng tải,” ông nói. Trong giai đoạn sớm của đời sống con người, có nhiều tế bào gốc điều khiển tương tự sư phát triển của răng, nhưng chúng trở nên không hoạt động sau khi răng người lớn của chúng ta được hình thành đầy đủ trong suốt thời thơ ấu.
Trong nghiên cứu gần đây, Tiến sĩ- nghiên cứu sinh sau tiến sĩ Brian Biehs và Tiến sĩ Jimmy Hu, xác định rằng có một nhóm các tế bào gốc trưởng thành tại vùng nền của các răng cửa chuột đang phát triển và các tế bào gốc có hoạt động của BMI1. Họ chỉ ra rằng BMI1 có thể ngăn chặn một tập hợp các gen gọi là gen Hox, mà khi được kích hoạt, sẽ khởi phát sự phát triển của các dạng tế bào đã chuyên hóa và cấu trúc cơ thể. Trong các răng cửa chuột, các nhà nghiên cứu đã chỉ ra rằng hoạt động của BMI1 trong các tế bào gốc duy trì số phận tế bào gốc của chúng và ngăn chặn sự biệt hóa tế bào không phù hợp bằng cách ức chế sự biểu hiện của gen Hox.
Vai trò thiết yếu trong sự phát triển này của BMI1 trong việc giám sát sự sản xuất các tế bào chuyên biệt có thể đã được bảo tồn qua tiến hóa, bởi vì các nghiên cứu về gen Hox ở ruồi giấm cho thấy rằng có thể có một vai trò tương tự của BMI1 trong côn trùng và động vật có vú, Klein nói.
Sử dụng các răng cửa chuột, Klein và các cộng sự có ý định tiếp tục khám phá bằng cách nào tế bào gốc và các đặc tính của chúng được đúc kết lần lượt bởi các dấu hiệu chúng nhận được từ các tế bào xung quanh.
“Kiến thức mới này rất hữu ích một cách cơ bản để tìm hiểu sự phân chia tế bào được kiểm soát như thế nào, và có thể giúp chúng ta thao tác các tế bào gốc để có bắt chúng làm những gì chúng ta muốn chúng trở thành”, Klein nói.
Dịch: Mỹ Hậu
Nguồn: http://www.sciencedaily.com/releases/2013/07/130719135707.htm