KHÁM PHÁ MỚI TRONG TÁI THIẾT LẬP CHƯƠNG TRÌNH TẾ BÀO
Năm 2012, John B. Gurdon và Shinya Yamanaka nhận giải thưởng Nobel Y học cho công trình tái thiết lập chương trình tế bào đã biệt hóa thành tế bào đa năng (iPS), tế bào này có những đặc tính giống tế bào gốc phôi, mở ra tiềm năng mới cho y học tái tạo.
Tuy có nhiều nhóm nghiên cứu trên thế giới nghiên cứu về quá trình này, sự tái thiết lập vẫn chưa được hiểu rõ, vẫn chưa có hiệu quả cao và chưa an toàn để có thể dùng trong y học tái tạo
Những nhà nghiên cứu tại trung tâm Điều hòa Bộ gene (Centre for Genomic Regulation –CRG), Barcelona đã có những bước tiến quan trọng để hiểu biết hơn về sự tái thiết lập chương trình và nâng cao hiệu quả của quá trình này. Con đường truyền tín hiệu Wnt đóng vai trò quan trọng trong sự tái thiết lập chương trình từ tế bào đã biệt hóa thành tế bào iPS
“Các nhân tố phiên mã được sử dụng trong sự tái thiết lập chương trình đóng vai trò làm tăng hoặc giảm sự tái thiết lập. Chúng tôi phát hiện có thể nâng cao hiệu quả quá trình này bằng cách ức chế con đường Wnt”, Francesco Aulicino, nghiên cứu sinh, nhóm Tái thiết lập chương trình và sự tái tạo
Con đường truyền tín hiệu Wnt bao gồm chuỗi các phản ứng sinh học diễn ra trong tế bào. Ở ếch hoặc thằn lằn, những phản ứng này cho phép tái tạo tứ chi trong trường hợp bị chấn thương. Ở người và động vật mất khả năng tái tạo nhưng con đường Wnt vẫn diễn ra trong một số quá trình như phát triển của thai và dung hợp tế bào.

|
|
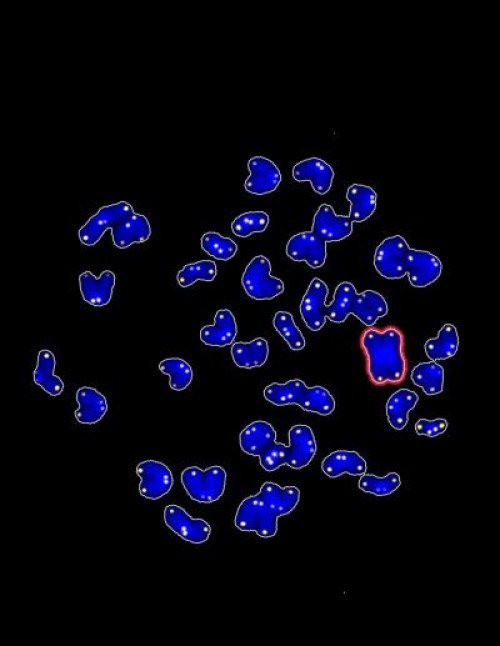
Hình: Tế bào đã hoạt hóa con đường Wnt không được tái thiết lập chương trình (xanh) nằm ở rìa, tế bào có thể được tái thiết lập ở vùng trung tâm (đỏ) (Nguồn: Center for Genomic Regulation) |
Con đường Wnt cũng diễn ra trong quá trình tái thiết lập chương trình. Các nhà nghiên cứu tại trung tâm này nghiên cứu con đường Wnt diễn ra như thế nào trong suốt quá trình tái thiết lập tế bào trưởng thành thành tế bào iPS (quá trình này thường kéo dài 2 tuần). Đây là quá trình động và Wnt hoạt động không phải trong suốt quá trình tái thiết lập. “Chúng tôi thấy rằng có 2 giai đoạn, trong mỗi giai đoạn, Wnt đóng những vai trò khác nhau. Và chúng tôi cũng thấy rằng nếu ức chế Wnt trong giai đoạn đầu và hoạt hóa Wnt ở giai đoạn cuối sẽ tăng hiệu quả tái thiết lập chương trình, và thu nhận được lượng lớn tế bào đa năng”, theo Ilda Theka, đồng tác giả nghiên cứu
Để có thể điều khiển con đường Wnt, nhóm nghiên cứu đã sử dụng chất ức chế Wnt, Iwp2, nhân tố này không tham gia tái thiết lập chương trình tế bào. Một số nghiên cứu khác sử dụng những nhân tố khác, tuy nhiên vẫn chưa đạt được kết quả
Nghiên cứu này cũng cho thấy thời điểm hoạt hóa Wnt mang tính quyết định đến sự tái thiết lập chương trình. Nếu hoạt hóa Wnt quá sớm dẫn đến tế bào bắt đầu biệt hóa (như thành tế bào thần kinh hoặc tế bào nội mô) và không tái thiết lập chương trình.
“Nghiên cứu này rất quan trọng và có những đổi mới trong lĩnh vực tái thiết lập chương trình tế bào bởi vì các quá trình hiện nay vẫn chưa đạt hiệu quả cao. Có nhiều nhóm nghiên cứu cố gắng tìm hiểu cơ chế tạo tế bào đa năng và nhân tố nào ức chế quá trình này mà chỉ có số ít tế bào có thể tái thiết lập chương trình”, theo Theka
Nghiên cứu này mở ra hướng đi mới trong lĩnh vực y học tái tạo và giúp hiểu rõ hơn về các loại khối u thông qua con đường Wnt. Có nhiều phòng nghiên cứu cũng nghiên cứu làm tăng hiệu quả tái thiết lập chương trình các loại tế bào trưởng thành, như PTN Haematopoietic Stem Cells, PTN Transdifferentiation and Reprogramming do ông Thomas Graf đứng đầu.
Trương Thị Hoàng Mai dịch
Theo Sciencedaily
Link bài báo: http://www.sciencedaily.com/releases/2014/05/140506130427.htm