Kỳ 2 – “Có thể?” là câu hỏi dành cho tương lai
Một cá thể được tạo ra từ tinh trùng và một tế bào không phải trứng là điều mà trước đây khoa học chưa thể thực hiện được. Nhưng giờ đây, các nhà khoa học đã làm được điều đó. Thế nhưng, liệu nghiên cứu trên có mang lại cho chúng ta một niềm tin rằng, một ngày nào đó các nhà khoa học có thể tạo ra một em bé được sinh ra từ hai ông bố, tức là một ông bố sẽ cho tinh trùng và ông bố còn lại sẽ cho một dòng tế bào bất kì mà không phải là tế bào trứng?
Để làm được điều kì diệu trên thì chúng ta phải nghiên cứu thêm trên những dòng tế bào khác. Thế nhưng, Tony Perry, người tham gia thực hiện nghiên cứu này, đã phát biểu: “Đây chỉ là những suy đoán và tất cả vẫn chưa thể thực hiện được tính tới thời điểm này, cũng có lẽ là không bao giờ!”
Vấn đề nằm ở đây chính là loại tế bào “trứng” cảm ứng hóa chất đặc biệt kia. Chúng giống nhưng cũng rất khác các tế bào bình thường của cơ thể. Những tế bào này có kích thước lớn hơn tế bào bình thường và không thể tái thiết lập chương trình để chúng có thể trở thành phôi.

Những đứa trẻ có gen từ 2 người cha vẫn còn là mục tiêu của tương lai
Vấn đề thứ hai nằm ở những tế bào trưởng thành của các ông bố. Chẳng hạn như tế bào da, chúng chứa tới 2 bộ nhiễm sắc thể trong khi các tế nào sinh dục chỉ cần một bộ nhiễm sắc thể là có thể tạo ra những phôi khỏe mạnh. “Trên hết, tất cả các điều này liên quan đến những bí ẩn chưa được tìm hiểu mà chúng ta chưa biết đến”, Perry nói.
Có vẻ như việc tạo ra một em bé với hai người đàn ông vẫn còn quá xa vời, nhưng nghiên cứu trên đã mang đến cho chúng ta một điều thú vị: có nhiều hơn một cách để tạo ra phôi khỏe mạnh.
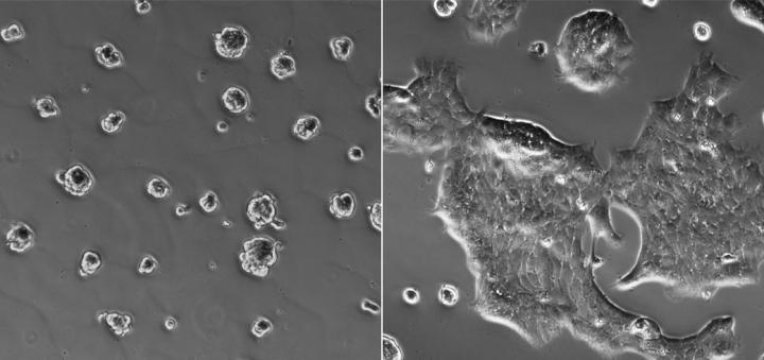
Khi phân tích hoạt động của gen trên những phôi này, nhóm của Toro nhận thấy biểu hiện gen của chúng khác với những gì chúng ta vẫn thường thấy ở những phôi bình thường được tạo ra từ tế bào trứng và tinh trùng. Thế nhưng, những phôi đặc biệt này vẫn có thể cho ra những chú chuột con khỏe mạnh. Như vậy, việc nghiên cứu sâu hơn về cơ chế trên có thể sẽ giúp chúng ta tìm ra các liệu pháp hiệu quả hơn trong điều trị.
Đặng Thanh Long – Nguyễn Xuân Quý
Theo New Scientist